60 90 Massa

Jumlah mol urea n gram mr 3 60 0 05 mol molaritas larutan m n v 0 05 0 25 0 2 molar maka molaritas larutan urea yaitu 0 2 molar atau 0 2 mol liter.
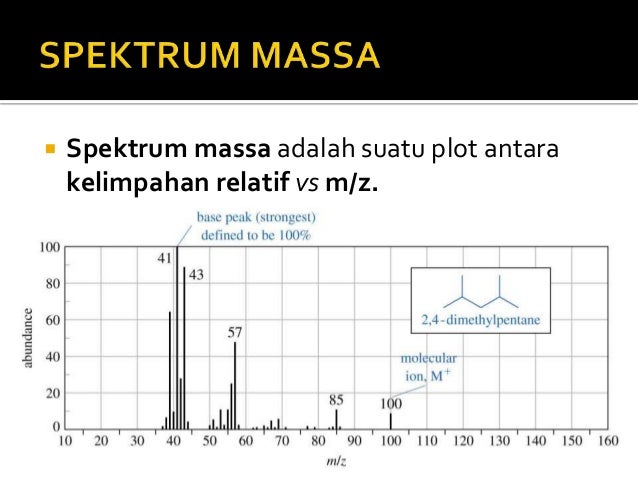
60 90 massa. Jadi fraksi mol urea co nh 2 2 yang dibuat dengan melarutkan 30 gr urea ke dalam 90 gram air sebesar 0 09. Ch2o n 90 1 ar c 2. Contoh perhitungan molalitas larutan. Memilah ion molekul dalam fase gas dari inlet diionisasi oleh berkas.
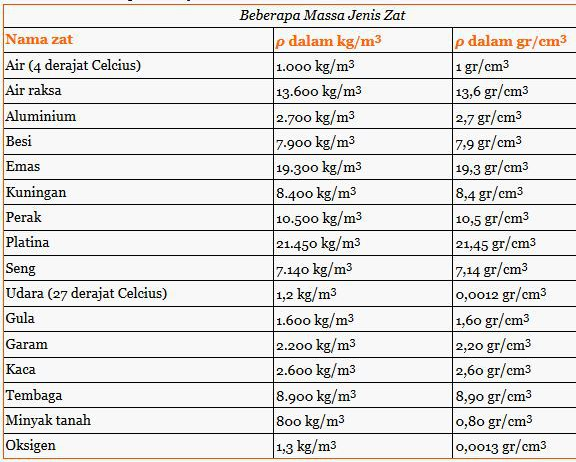
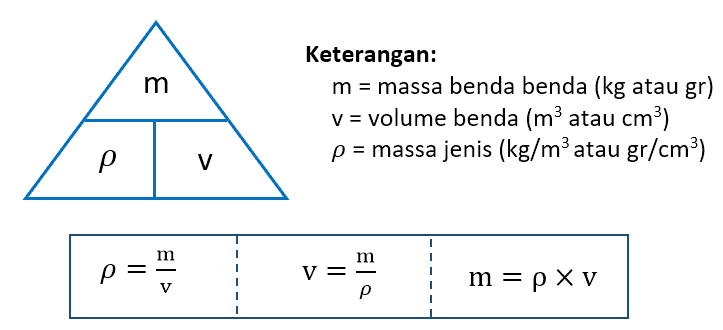
Jika terdapat 17 gram suatu oksida logam dengan rumus empiris m2o3 mempunyai kandungan 8 gram oksigen. Besaran massa jenis dapat membantu menerangkan mengapa benda yang berukuran sama memiliki berat yang berbeda. O 18 02 g mol e 1 60 x 10 19 c 1 v 1 kg m2 s2 c prinsip ms. Perhitungan neraca massa h20 yang bereaksi 45 0938 15 0313 kmol 270 5628 kg 2 hno hasil 45 0938 30 0625 kmol 1136 3636 kg 3 no mula 74 9481 kg 2 4983 kmol no yang bereaksi 45 0938 15 0313 kmol 3 no hasil 15 0313 2 4983 17 5295 kmol 525 8861 kg a 6 untuk menghasilkan hno 60 h20 yang ditambahkan 1028 1386 kg.
Massa air sebagai pelarut 100 10 gram 90 gram. Maka berapakah ar logam m tersebut. N h 2 o 90 18 5 mol. Massa zat cair 90 70 24 g massa botol sarat air 90 g massa air yang volumenya sama 90 70 20 g.
Terima kasih brainly nilaiku yg tadi juga jelek 60 50 40 sekarang matematika jadi 100 99 98 wah kerren. Massa air yang volumenya sama 24. N co nh 2 2 30 60 0 5 mol. Molaritas larutan urea bisa dihitung dengan cara.
Misalnya 10 gram natrium hidroksida naoh dilarutkan. Berat dituliskan dalam kgf. Memilah ion lintasan lengkung r ion tergantung pada b. Aku sekarang kelas 6 tryout kemarin aku rangking 1.
Newton adalah satuan si. Larutan nacl 10 massa berarti dalam 100 gram larutan nacl terdapat nacl murni sebanyak 10 x 100 gram 10 gram. 90 atau 60o prinsip ms. Massa jenis relatif massa zat cair.
Brainly belajar jadi luar biasa terima kasih brainly rusi hastarii. Gunakan kecerdasan ribuan ahli dan pakar di seluruh dunia. Berapa fraksi mol pelarut yang dibuat dengan melarutkan 90 gram glukosa mr 180 dalam 90 gram air mr 18. Jika ar o sebesar 16.
Ar o n 90 1. Massa o 8 gram. Sehingga rumus molekul senyawanya ialah c3h6o3. Massa molekul relatif urea adalah 60.
Massa ms prinsip dan instrumentasi prinsip ms. Molalitas 10 x 1000 1 899 1 9 m. Jadi massa jenis relatif dari zat cair tersebut ialah 1 2. Konsentrasi larutan asam formiat hcooh 4 6 massa dengan massa jenis 1 01 g ml adalah mr chooh 46.
Massa 90 newton m s 2 massa 90 kg m s 2 m s 2 sederhanakan satuan massa 90 kg. Kg adalah satuan massa yang tepat. Massa h 2 o 90 gr.